结构生物学旨在从原子和分子层面解析生物大分子的三维结构,从而理解其功能机制。在这一前沿研究领域,获得高纯度、具有正确折叠和功能的重组蛋白是进行结构解析(如X射线晶体学、冷冻电镜、核磁共振等)不可或缺的前提。其中,人胚胎肾细胞系的悬浮培养变种——293F细胞,因其独特的优势,已成为表达复杂重组蛋白,尤其是需要进行结构生物学研究的蛋白质的“明星”平台。
293F悬浮细胞系统的核心优势
293F细胞是经过改造适应于无血清悬浮培养的HEK293细胞系。相较于传统的贴壁培养或原核表达系统,其在重组蛋白表达方面具备显著优势:
1. 高效蛋白合成与分泌:293F细胞具有高效的转录翻译后修饰能力,能够完成复杂的翻译后加工,如糖基化、磷酸化、二硫键形成等。这对于膜蛋白、分泌蛋白以及许多功能依赖于精确修饰的人源蛋白的正确折叠和活性至关重要。其悬浮培养模式便于高密度、大规模培养,可实现毫克至克级别的蛋白产量,满足结构生物学对样品量的高需求。
2. 适用于复杂蛋白:许多具有重要生物学功能和药物靶点潜力的蛋白质(如GPCRs、离子通道、多亚基复合物、抗体等)在原核系统中难以表达或无法正确折叠。293F细胞的真核表达环境,使其成为表达这些复杂、大分子量蛋白的理想选择,为解析其高分辨率结构铺平了道路。
3. 工艺稳定且可放大:悬浮培养技术成熟,易于通过生物反应器进行工艺放大,保证了蛋白表达批次间的稳定性和可重复性,这是确保后续结构研究数据质量的关键。
在结构生物学研究中的关键应用流程
利用293F悬浮细胞进行重组蛋白表达以支持结构生物学研究,通常遵循一套标准化的流程:
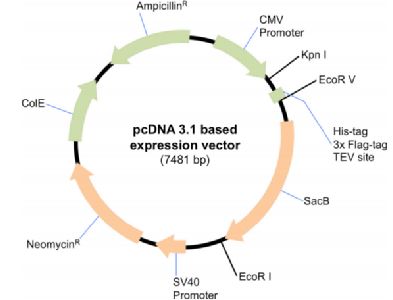
- 基因构建与转染:将目标蛋白的基因克隆至适合哺乳动物细胞表达的载体中,通常采用瞬转(如PEI、脂质体法)或构建稳定细胞系的方式,将载体导入293F细胞。瞬转因其快速、灵活的特点,在初期筛选和优化中应用广泛。
- 大规模培养与表达:将转染后的细胞在优化的无血清培养基中进行悬浮培养,通过控制温度、pH、溶氧和营养供给等参数,诱导目标蛋白高效表达并分泌到培养基中,或通过裂解细胞获取胞内蛋白。
- 蛋白纯化与质量评估:收集培养上清或细胞裂解液,经过一系列层析步骤(如亲和层析、离子交换、分子筛等)进行纯化。获得的高纯度蛋白需通过SDS-PAGE、质谱、分析型分子筛、圆二色谱等手段评估其纯度、均一性、单分散性和折叠状态。一个均一、稳定的蛋白样品是成功结晶或用于冷冻电镜制样的基础。
- 结构解析:将纯化合格的蛋白样品用于结构解析。例如,用于结晶的蛋白需要达到极高的纯度和浓度;用于单颗粒冷冻电镜分析的蛋白,则需保持良好的结构完整性和构象均一性。最终获得的三维结构,将直接揭示该蛋白的活性位点、相互作用界面以及潜在的功能机制。
挑战与未来展望
尽管293F系统优势突出,但仍面临挑战,如某些蛋白表达量低、翻译后修饰与天然状态可能存在差异、培养成本较高等。未来的发展将集中于:进一步优化表达载体和培养工艺以提高产量和质量;利用基因编辑技术(如CRISPR)改造293F细胞系,使其更精准地模拟特定修饰或辅助蛋白折叠;以及将293F表达系统与自动化、高通量的结构生物学筛选平台更紧密地结合,加速从基因到结构的发现进程。
293F悬浮细胞表达系统作为连接基因序列与蛋白质三维结构的强大桥梁,已成为现代结构生物学和生物医药研究中不可或缺的工具。它极大地拓展了可进行结构解析的蛋白范围,为理解生命过程的分子基础和创新药物设计提供了坚实的物质基础。